为深入理解大脑皮层的功能机制及神经系统疾病的病理基础,构建高分辨率的皮层神经元空间生理图谱至关重要。尽管已有研究逐步揭示了单个皮层的细胞构成,但对于跨越多个人类皮层区域的神经细胞,其系统的分子特征与精确的空间组织结构仍未被完整解析。这一认知空白严重制约了我们对大脑功能整体性与区域特异性的深入探索。
2025年8月,南方医科大学与哈尔滨医科大学等单位合作,在Nature Communications发表重磅成果。研究人员通过单细胞核测序技术(snRNA-seq)与亚细胞水平时空组学技术(Stereo-seq),绘制出了迄今最全面、分辨率最高的人类大脑皮层14个脑区的单细胞空间图谱,为解析神经细胞的空间组织、功能关联及疾病机制提供了"分子坐标"。
 文章页面截图
文章页面截图
1.研究对象:人类大脑14个关键皮层区域
2.核心技术:时空组学技术(Stereo-seq)、单细胞核测序技术(snRNA-seq)
3.样本规模:
Stereo-seq:44张脑切片
snRNA-seq:5名健康供体的42个样本
研究表明,谷氨酸能神经元可根据其投射模式划分为9个亚类。其中,脑内投射型(Intratelencephalic, IT)神经元在转录组特征与空间分布上呈现连续梯度变化。进一步分析发现,空间位置邻近的皮层区域之间,其谷氨酸能神经元的转录组特征更为相似。值得注意的是,IT神经元亚类间的表达差异主要受皮层层状结构变化的调控,而受脑区特异性影响相对较小。
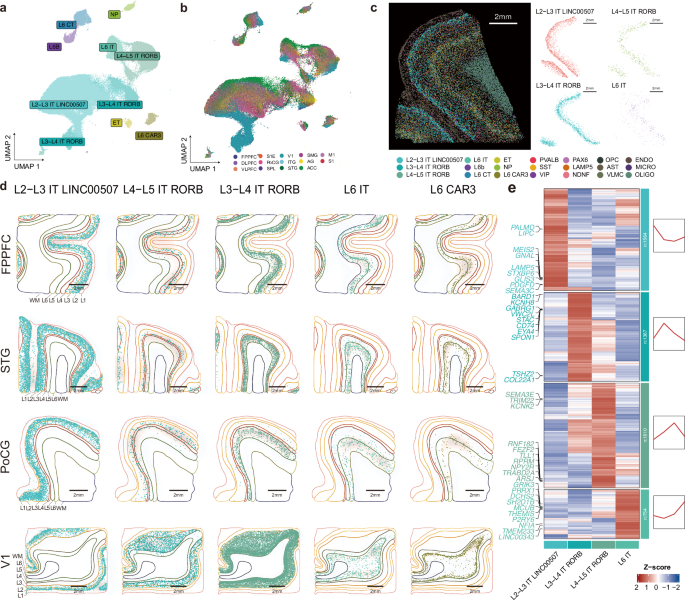
图1.谷氨酸能细胞类型的转录组分类及其在人类大脑皮层中的空间排列
研究通过整合神经细胞图谱与fMRI功能数据,系统解析了特定细胞类型与脑功能的关联。研究发现,前额叶中富集的RORB神经元可能参与高级认知功能,而中央沟区域的脑外投射型(Extratelencephalic,ET)神经元则与疼痛处理密切相关。研究进一步揭示了神经元与星形胶质细胞通过NRG3–ERBB4等通路进行交互,且这种神经-胶质通讯模式在不同脑区存在显著差异。
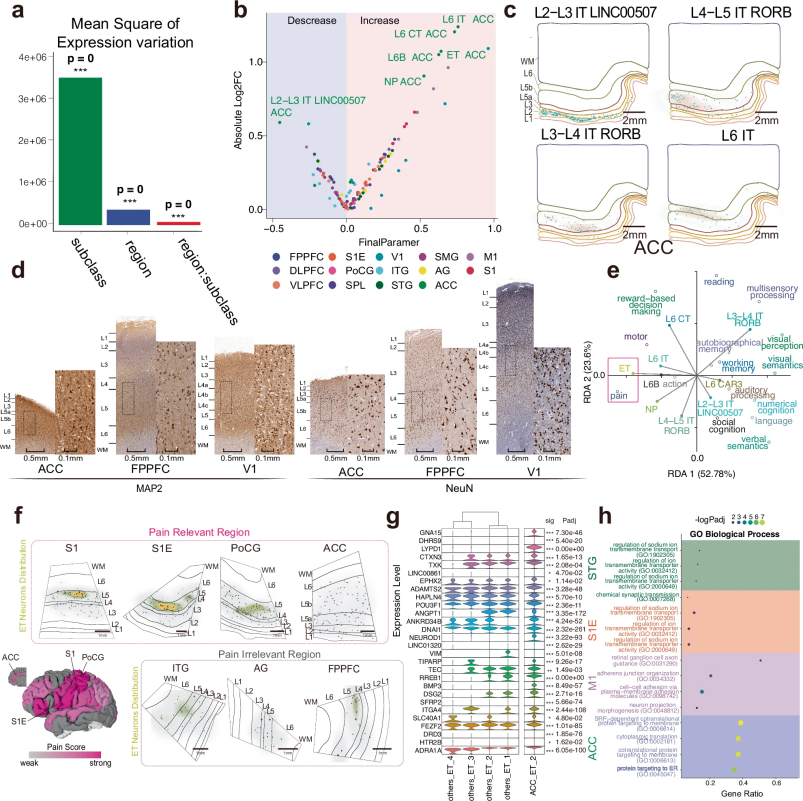
图2. ET神经元在疼痛相关皮层区域的区域特异性分布及功能富集分析
生长抑素(Somatostatin ,SST)神经元皮层中呈现明确的层状分化特征,可分为浅层与深层两个功能亚群。研究首次系统揭示了这两个亚群在皮层层级结构中的分布轨迹与功能特化:浅层SST神经元高表达CALB,主要接收同层兴奋性输入;而深层SST神经元则显著富集与G蛋白偶联受体信号通路相关的基因,暗示其在跨层信号调控中的作用。值得注意的是,这种分层特化模式在人类大脑中表现出比小鼠模型更显著的复杂性与分化程度。
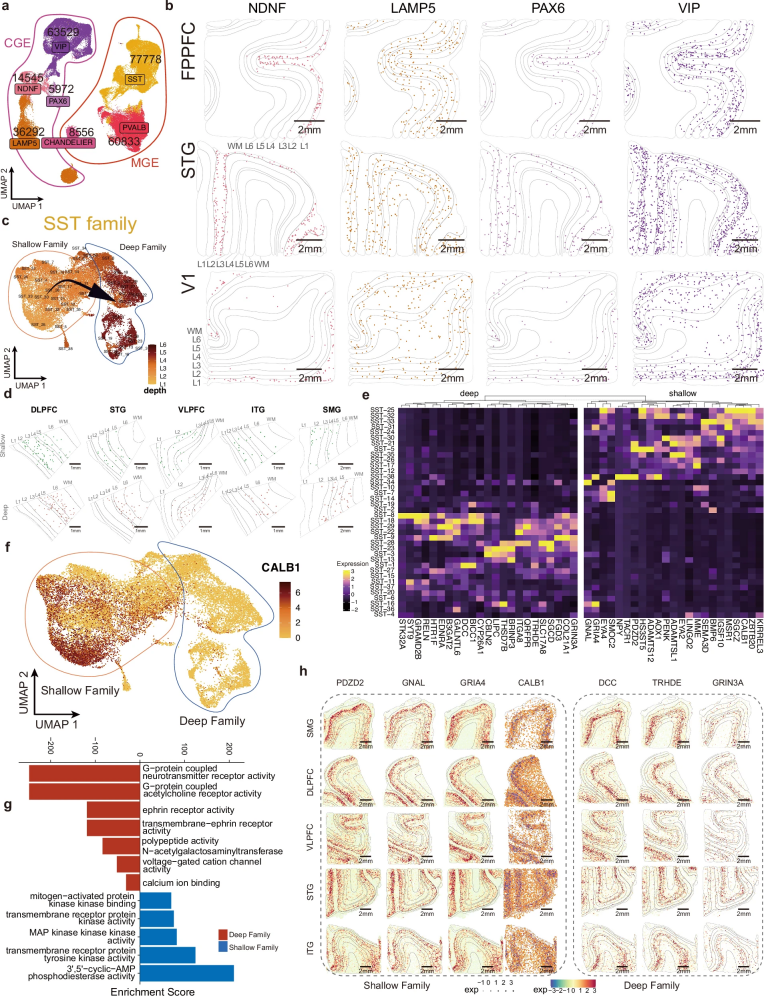
图3. 人类皮质区域中GABA能神经元亚类的特征分析与空间分布
▶ 颠覆传统认知:大脑“过渡层”第六b层实为重要永久结构
研究人员首次在14个皮层区域中利用空间转录组学系统解析第4层(颗粒层)与第6b层(亚板层)的细胞组成分布。研究显示,视觉皮层(V1)的第4层最大,明显超过在其他皮层区域的比例,RORB神经元富集。利用该图谱分析第6b层,发现其表达皮层亚板神经元的标记物,如CTGF、SEMA3E和MGST1等,表明第6b层不是一个短暂的结构,可能是一个永久性的亚群。
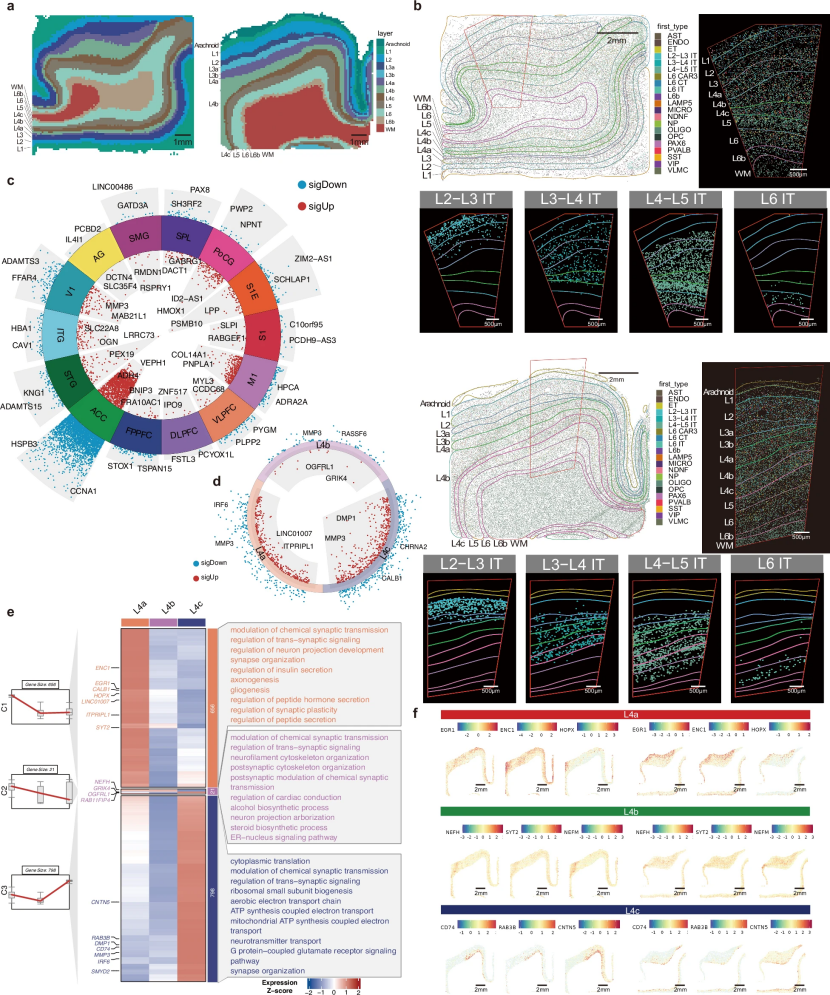
图4. 视觉皮层中RORB谷氨酸能神经元的空间分布差异
大脑研究迎来“空间导航”时代,Stereo-seq精准绘制细胞“定位地图”。
过去,单细胞测序如同将大脑“打成匀浆”,我们能获得细胞类型的列表,却彻底丢失了它们的位置信息。空间转录组学的诞生,让我们首次能够在不破坏组织结构的条件下,直接观察基因在原始位置上的表达。
本研究的关键在于Stereo-seq技术,它以其500纳米的超高分辨率(接近单个细胞大小),为大脑拍摄了一张“高清定位照片”。结合snRNA-seq提供的细胞“身份证”(转录组指纹)和DeepST算法,研究团队成功地将数万个细胞精准地标注回它们在大脑中的“原始住址”。
这项突破意味着,脑科学研究正从一场“人口普查”(知道有哪些细胞),升级为一次对细胞社会“微观地理”的精确测绘。我们不仅能列出神经元的种类,更能看清它们在大脑中的实际分布、邻居是谁、以及如何形成复杂的功能网络。这为理解大脑如何工作以及疾病如何破坏这些精细结构,提供了前所未有的视角,真正推动了该领域从“盲人摸象”走向“全景导航”。

 文章页面截图
文章页面截图


