癌症不仅是局部病变,更是善于“系统伪装”的全身性疾病。免疫疗法有时失效,部分原因在于肿瘤能通过未知的“远程信号”瓦解全身免疫防御。近年来,科学家发现肿瘤内的痛觉神经元可能是关键信号节点,但它如何远程调控肿瘤引流淋巴结这一免疫指挥中心,始终是未解之谜。
近日,复旦大学附属中山医院与上海交通大学医学院附属第九人民医院合作在 Cell 杂志上发表了一项研究成果。研究发现肿瘤内痛觉神经元的密度与肿瘤相关巨噬细胞的积聚呈正相关。随后,团队利用多种基因工程小鼠,结合化学遗传学与光遗传学技术,实现了对神经活性的精准调控与功能验证。
进一步地,通过整合单细胞转录组测序、时空组学技术Stereo-seq等多组学分析,系统解析并确定了ATF4-SLIT2-CCL5这一关键的神经免疫调控轴。最后,研究在三种小鼠肿瘤模型中证实,靶向该通路能有效增强免疫检查点抑制剂的抗肿瘤效果。

研究对象:头颈鳞状细胞癌(HNSCC)患者及小鼠口腔癌模型
核心技术:空间单细胞蛋白组(CODEX)、单细胞转录组测序、时空组学(Stereo-seq),以及血浆蛋白组和质谱流式(CyTOF)等技术
样本规模:
头颈鳞癌中痛觉神经的增生与肿瘤进展密切相关。临床分析发现,肿瘤内痛觉神经密度越高,患者疼痛越剧烈,且局部伴随大量促肿瘤的M2型巨噬细胞聚集,同时患者全身呈现抗肿瘤免疫细胞减少的抑制状态。
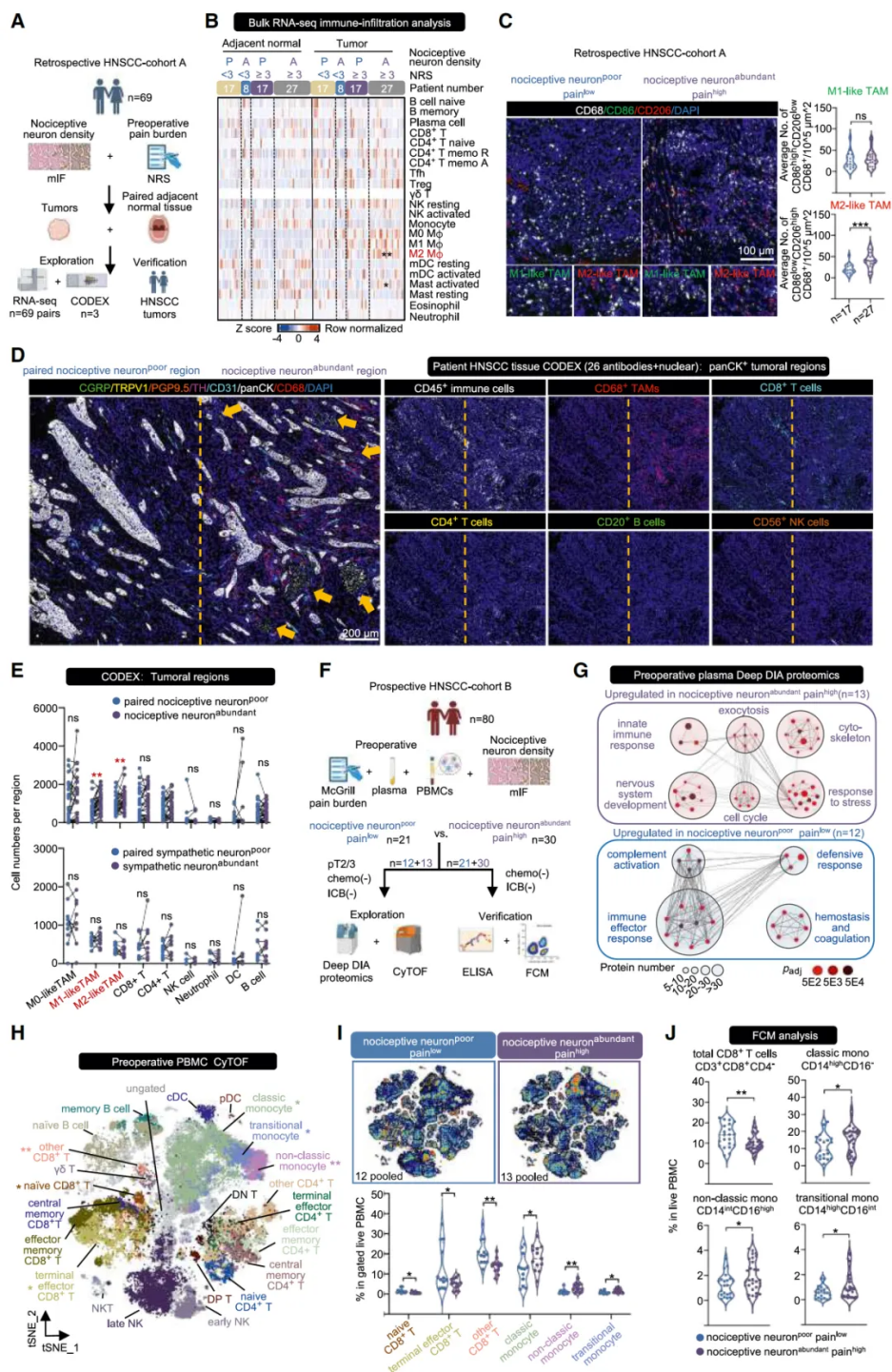
图1. 高密度的伤害性神经元与头颈鳞状细胞癌(HNSCC)患者中的肿瘤相关巨噬细胞(TAM)积聚相关
机制上游:癌细胞如何发出“疼痛信号”?
研究表明,肿瘤相关巨噬细胞(TAMs)是触发癌痛的上游因素。它能诱导癌细胞发生内质网应激,激活转录因子ATF4,进而促使癌细胞大量分泌SLIT2蛋白。SLIT2直接激活痛觉神经元,引发疼痛;而敲除癌细胞中的ATF4或SLIT2基因可基本阻断该过程。
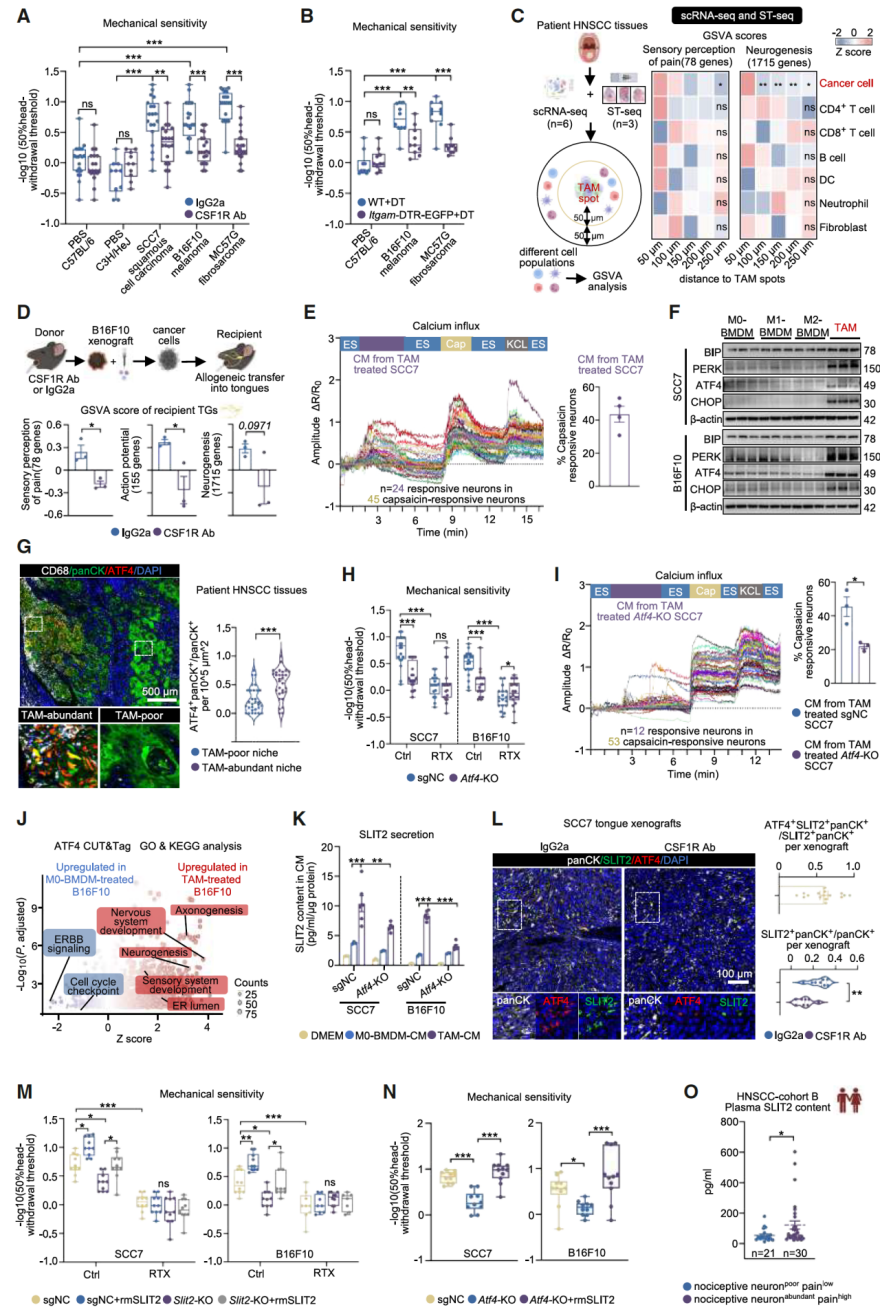
图2. TAM压力下,癌细胞通过ATF4介导的SLIT2分泌激活伤害性神经元
研究人员进一步发现,癌痛的影响并不局限于肿瘤内部。通过光遗传学技术激活小鼠舌部的痛觉神经元后,支配颈部肿瘤引流淋巴结(TDLN)的痛觉神经元也被同步激活。这表明,肿瘤局部的疼痛信号能够通过神经网络“广播”到区域免疫的关键枢纽,从而直接将肿瘤局部事件与系统性免疫器官的功能联系起来。
研究发现,肿瘤通过激活引流淋巴结(TDLN)内的痛觉神经元,使其释放CGRP,从而抑制局部免疫。关键证据来自Stereo-seq空间转录组分析:抑制这些神经元后,TDLN内抗肿瘤免疫细胞增多,且形成更多紧密互动的“免疫激活生态位”。这表明,被劫持的神经元通过释放CGRP,显著削弱了TDLN的免疫指挥功能。
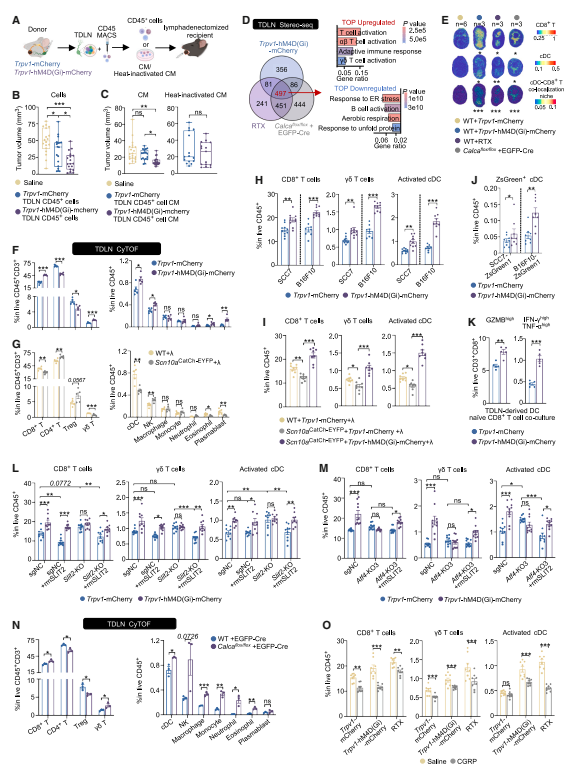
图3. TDLN-iNN的活性可将其重塑为免疫抑制状态
揭示“肿瘤-神经-淋巴结”环路新机制:CCL5介导免疫抑制与肿瘤进展
研究完整阐明了癌细胞利用“肿瘤-神经-淋巴结”的跨器官回路促进进展的机制:通过Stereo-seq等多组学分析发现,被激活的引流淋巴结(TDLN)痛觉神经元通过释放CGRP,抑制了TDLN内关键趋化因子CCL5的分泌;CCL5的减少进而驱动肿瘤内巨噬细胞(TAM)向促瘤的M2型极化,形成恶性循环,加速肿瘤生长并削弱免疫治疗。
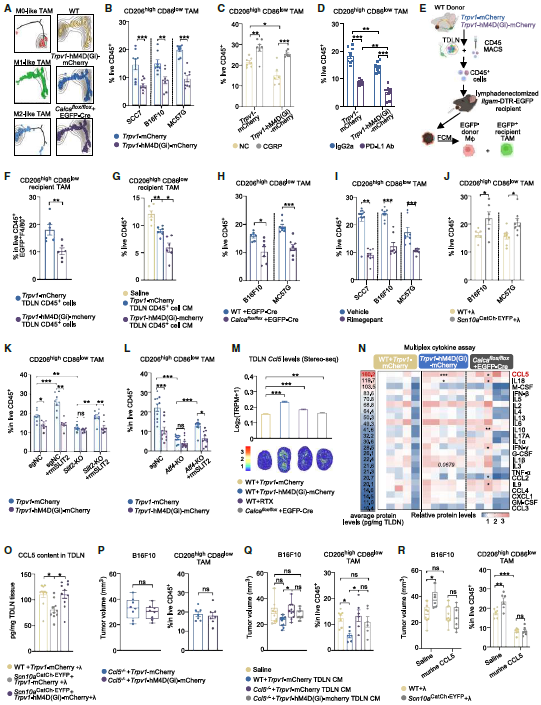
图4. 免疫抑制的TDLN通过减少CCL5分泌促进TAMs向M2极化
本研究突破了传统“肿瘤微环境”框架,首次揭示肿瘤通过神经信号远程操控全身免疫系统,实现了癌症免疫研究范式从局部到系统的转变。
研究融合多重前沿技术,特别是通过时空组学技术Stereo-seq直观呈现了肿瘤引流淋巴结内免疫细胞空间互作的动态演变,实现了功能与空间定位的精准关联。
研究发现了多个可干预靶点,并验证了利用已上市神经药物增强免疫疗法的可行性,其“老药新用”策略为临床转化提供了清晰、快速的路径。
以上研究基于时空转录组 FF 产品方案开展。该产品方案目前升级为时空转录组FF V1.3,在保持Stereo-seq技术“纳米级分辨率”和“厘米级全景视场”的两大优势下,通过优化时空试剂、酶、探针设计以及算法软件完成性能优化与提升。升级后,其捕获效率大幅提升,工作流程更快速简便,用户友好性显著增强,可助力研究人员轻松获得每个细胞内的更多高质量转录本数据,为各种应用场景下的科学研究提供无与伦比的洞察力。







