随着犬类年龄增长,其大脑中会出现与人类阿尔茨海默病(AD)相似的病理特征,这使它们成为一个极富潜力的天然研究模型。然而,目前我们对于犬类大脑在健康衰老和认知功能障碍(CCD)状态下究竟发生了怎样的细胞与分子层面的动态变化,仍知之甚少。
2025年9月15日,江西农业大学、山东畜牧兽医职业学院等团队联合在National Science Review发表研究成果,研究团队创新性整合单核RNA测序snRNA-seq与时空组学技术Stereo-seq,首次绘制健康衰老与认知功能障碍(CCD)的犬脑分子图谱,揭示了认知障碍犬中小胶质细胞C1QA与神经元CRT互作介导突触损伤的新机制。

胶质细胞是衰老大脑的“动态重塑者”
就像机体随年龄调整生理状态一样,大脑中的胶质细胞(相当于大脑的“支撑养护系统”,负责神经保护、营养供给等基础保障)在衰老过程中并非静止不变,而是展现出显著的“转录可塑性”——能主动调控自身基因表达模式,完成适应性的“转录重编程”。
其中,少突胶质细胞、小胶质细胞和星形胶质细胞这三类核心胶质细胞的变化最为突出。更关键的是,研究还首次发现了这三类细胞中的两种“衰老特异性亚型”:小胶质细胞中的Micro MBP⁺亚型和星形胶质细胞中的Astro MBP⁺亚型,二者均直接参与髓鞘合成(髓鞘相当于包裹神经纤维的“绝缘保护鞘”,保障神经信号高效传导)。
此外,少突胶质细胞内存在一种名为ZEB1的“分化调控开关”(转录因子),它的表达量会随衰老逐渐降低,而该因子正是调控少突胶质细胞成熟分化的关键,这一调控规律此前尚未被发现。

图1 基于单核与空间技术的犬脑多区域转录组图谱
CCD致病的“精准攻击路径”找到:小胶质细胞与海马神经元的“不良互动”损伤突触
若将大脑突触比作“神经信号传递的关键节点”(负责神经元间的信息沟通),那么CCD(相关病理性衰老)的致病机制,就是这条“沟通链路”被精准破坏的过程。
研究发现,CCD犬大脑中,小胶质细胞来源的蛋白C1QA,会与海马神经元中的CRT蛋白发生“异常结合”。这种结合并非正常生理互动——细胞共培养实验证实,二者结合后会直接导致突触标志物SYN1的表达显著下降,就像“突触连接”的核心功能组件失效,最终造成突触损伤。
这一异常互作机制先通过空间转录组Stereo-seq数据锁定位置关联,再经细胞实验验证功能影响,完整明确了CCD致突触损伤的分子路径。
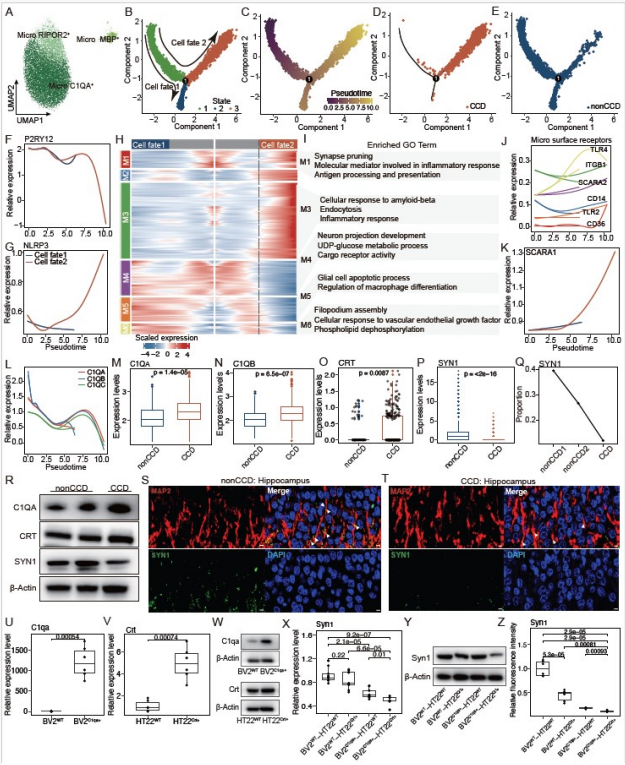
图2 小胶质细胞激活的转录动力学揭示C1QA-CRT相互作用介导犬认知障碍中的突触损伤
小胶质细胞是区分“健康衰老”与“病理性衰老”的“关键标尺”,AD风险基因更偏爱它
研究筛选阿尔茨海默病(AD)相关风险基因后发现,这些“疾病风险因子”大多在小胶质细胞中高度富集,也就是说小胶质细胞是AD风险基因的“核心表达载体”。更重要的是,小胶质细胞的功能状态可作为区分“健康衰老”与“CCD病理性衰老”的关键标志:CCD犬的小胶质细胞代谢淀粉样前体蛋白的能力,远低于正常衰老犬,就像小胶质细胞的“病理性物质清除功能”出现了退化。这一发现提示,小胶质细胞的功能衰退很可能是CCD病理进程启动或加剧的核心环节之一。

图3 小胶质细胞中正常衰老与CCD病理的比较性见解
通过整合单核转录组与空间转录组技术,实现了从“细胞图谱”到“空间互作”的跨越。不仅揭示了衰老相关的新型胶质细胞亚型(如Micro MBP⁺和Astro MBP⁺),更关键的是,在组织原位直接捕捉到小胶质细胞C1QA与神经元CRT的空间邻近关系,从而在空间维度验证了其介导突触损伤的分子通路。
这一发现表明,空间转录组能够精准解析脑内关键细胞间的病理对话,为阐明神经退行性疾病中的细胞间通讯机制提供了不可替代的技术路径。
本研究整合单核转录组(snRNA-seq)与时空组学技术(Stereo-seq),首次构建了犬脑衰老与认知障碍的多区域图谱。研究发现胶质细胞是衰老关键调控者,鉴定出两类参与髓鞘合成的衰老相关新亚型(Micro MBP⁺与Astro MBP⁺),并揭示转录因子ZEB1调控少突胶质细胞分化且表达随衰老下降。在认知障碍机制中,发现小胶质细胞C1QA与神经元CRT互作导致突触损伤,且其代谢淀粉样蛋白能力显著降低,为阿尔茨海默病等疾病研究提供了新靶点与思路。




