斑马鱼的眼球受损后能奇迹般再生,而人类一旦视网膜受损,视力丧失却往往不可逆转。这背后的根本差异是什么?人类眼中是否也藏着再生的“种子”?这个困扰了全球眼科界二十余年的问题,如今迎来了里程碑式的答案。
2025年3月26日,温州医科大学附属眼视光医院团队在Science Translational Medicine以封面文章发表重磅研究,利用华大时空组学技术Stereo-seq,首次在人类眼中发现并证实了具有再生潜能的神经视网膜干细胞(hNRSCs),并成功揭示了调控其活性的关键基因“开关”。
该成果一举入选2025年全球眼科十大突破进展,为数百万视网膜色素变性、年龄相关性黄斑变性等致盲性疾病患者带来了治愈的曙光。
研究速览

点击阅读全文
关键研究内容
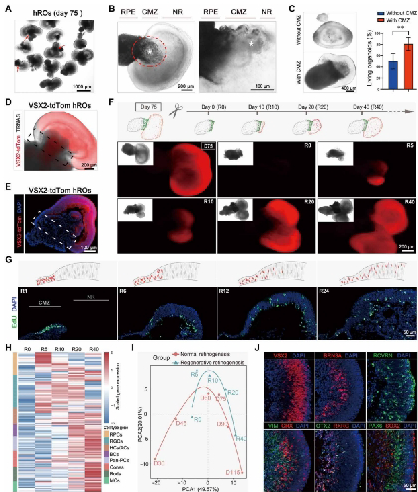
Stereo-seq绘制“细胞地图”,精确定位再生“种子细胞”
传统单细胞测序技术虽能解析细胞类型,却无法回答“细胞在哪儿”这一关键问题。而Stereo-seq技术凭借其纳米级分辨率和厘米级全景视场,首次绘制了人眼全尺度的空间转录图谱。通过该技术,团队在睫状缘区非色素上皮层中精准锁定了一群高表达MECOM、CPAMD8等干性基因的细胞群体——人类神经视网膜干细胞(hNRSCs),并明确其空间分布特征。
Stereo-seq的空间定位能力突破了传统测序技术的局限,为后续靶向干预提供了解剖学依据。
的空间分布与分化潜能.png)
图1 hNRSCs在睫状缘区(CMZ)的空间分布与分化潜能
类器官模型再现再生过程,MECOM基因充当“命运开关”
找到“种子”后,如何验证其功能?团队构建了包含CMZ结构的人视网膜类器官(hROs),并模拟损伤环境。令人振奋的是,位于CMZ的hNRSCs在损伤后被迅速激活,它们定向迁移至损伤区域,并分化为新的功能细胞,成功修复了损伤结构。机制研究发现,MECOM基因是掌控这场“修复大戏”的核心开关,与TBX20、NFIA等转录因子协同作用,共同调控hNRSCs向神经视网膜谱系的定向分化,并驱动其在类器官损伤修复过程中的再生响应。
理论的最终考验是实践。团队将hNRSCs移植到视网膜色素变性模型小鼠(RD10)眼中。结果证实,移植的细胞不仅能成功整合到宿主视网膜,分化为感光细胞,更在功能上实现了突破:电生理检测显示,小鼠的视网膜电图反应显著改善。
行为学分析表明,小鼠的视动反应得到恢复,这意味着其“视力”真正得到了提升。长达6个月的观察显示,移植细胞未形成肿瘤,展现了良好的生物安全性。
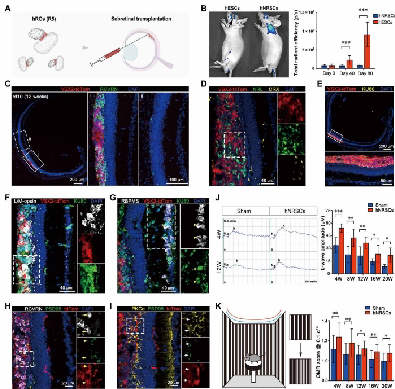
Stereo-seq技术推动再生医学从“细胞识别”迈向“空间干预”。本研究通过Stereo-seq的空间分辨率优势,不仅解决了hNRSCs的“身份认证”问题,更明确了其“行动坐标”。这一突破凸显了时空组学在复杂组织研究中的价值:当细胞位置与功能被同步解析,靶向治疗策略的精准度将实现跃升。
研究首次系统鉴定了人类视网膜内源性干细胞hNRSCs,通过多组学与类器官模型阐明其再生机制,并在动物实验中验证治疗潜力。这一发现为开发针对视网膜退行性疾病的再生疗法提供了新细胞来源与干预靶点,有望推动不可逆性失明的治疗从概念走向临床。


的空间分布与分化潜能.png)

