细胞的身份由DNA中的“增强子”序列决定,它们像开关一样控制基因活动。尽管哺乳动物(如人类、小鼠)和鸟类(如鸡)的大脑发育起点相似,但最终结构却大不相同——最明显的区别是,哺乳动物演化出了独特的六层新皮层,而鸟类没有。
这种巨大的结构差异,使得鸟类与哺乳动物的大脑是否存在同源关系,成为数十年来争论的焦点。传统的科研方法难以破译增强子中复杂的“调控密码”,因此一直无法从最根本的编码层面解答这个进化谜题。
2025年2月,比利时鲁汶大学联合多国科研团队,在Science发表了一项具有里程碑意义的研究。该工作整合了鸡端脑的单细胞多组学与Stereo-seq空间转录组数据,并利用深度学习模型从基因组增强子序列中解码细胞类型的调控密码,系统比较了鸟类与哺乳动物的大脑。
研究发现,支持性非神经元与抑制性GABA能神经元的增强子编码在进化中高度保守,而兴奋性神经元则展现出复杂的“多对多”同源关系。这一发现突破了传统脑进化模型中一一对应的简化框架,从基因调控层面为理解大脑的演化机制提供了全新视角。

点击阅读全文
研究对象:鸡端脑、小鼠端脑、人类大脑皮层。
核心技术:时空组学技术Stereo-seq、单细胞多组学(scATAC-seq + scRNA-seq)、深度学习模型。
样本规模:该研究整合了来自鸡端脑(包含23,179个单细胞和27,487个空间bin)以及小鼠和人类(各2个单细胞数据集)的跨物种脑细胞数据。
技术突破:给鸡脑画一张 “超高精度地图”
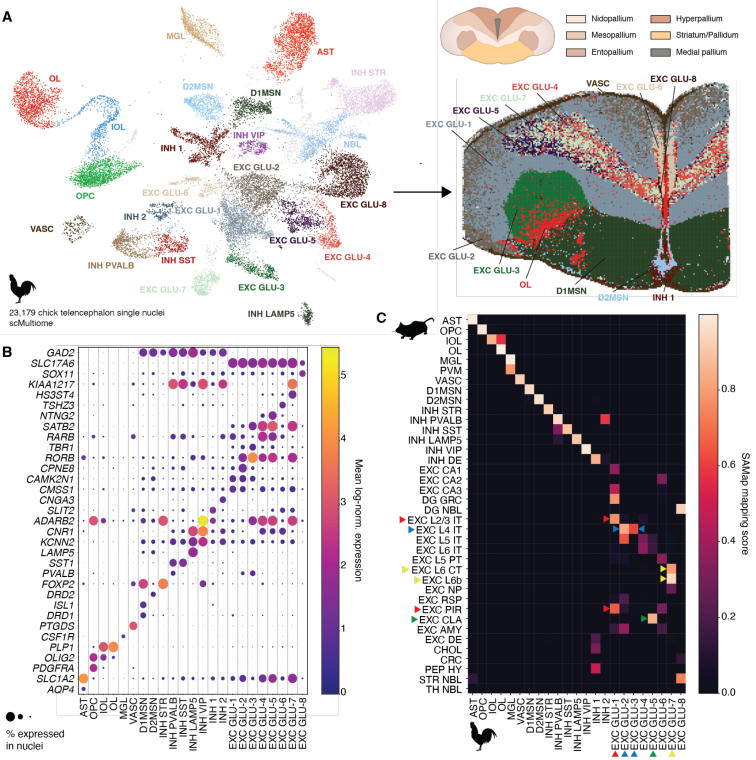
研究团队首先利用单细胞多组学技术,结合时空组学技术Stereo-seq,以纳米级分辨率构建了鸡端脑的高精度细胞图谱。这一技术整合不仅明确了细胞类型,还精准定位了其空间分布,为跨物种比较提供了关键数据基础(图1)。
图1 鸡端脑的细胞类型及标记基因的表达
高度保守:非神经元与 GABA 能神经元的 “祖传密码”
研究发现,非神经元细胞(如胶质细胞)和抑制性GABA能神经元的增强子编码在物种间高度保守(图2)。通过深度学习模型对增强子序列的分析表明,这些细胞的调控机制在3.2亿年的进化中保持稳定,例如小鼠FIRE增强子在鸡和人类中功能高度相似。
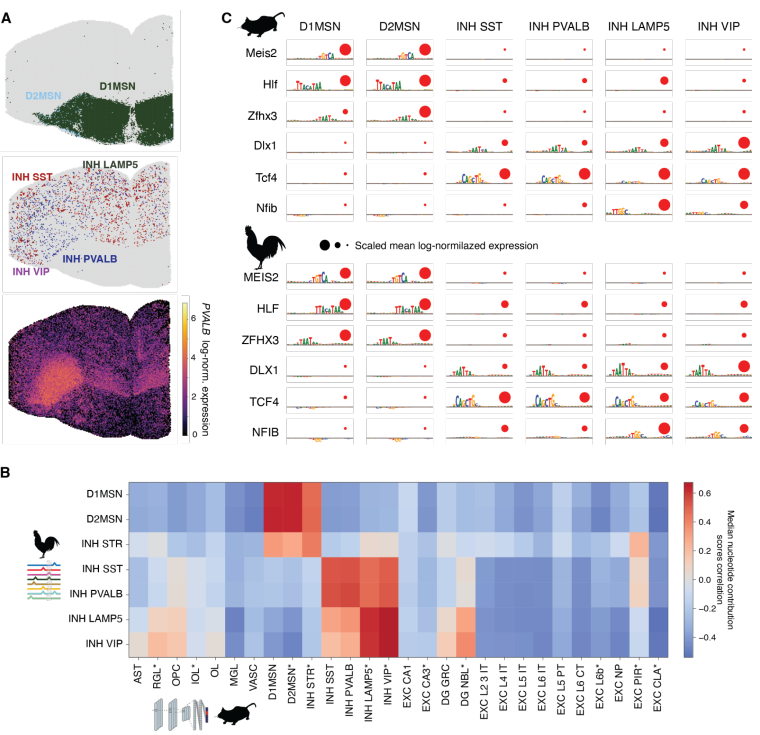
图2 小鼠和鸡GABA能神经元的保守增强子编码
复杂多样:兴奋性神经元的 “进化创新”
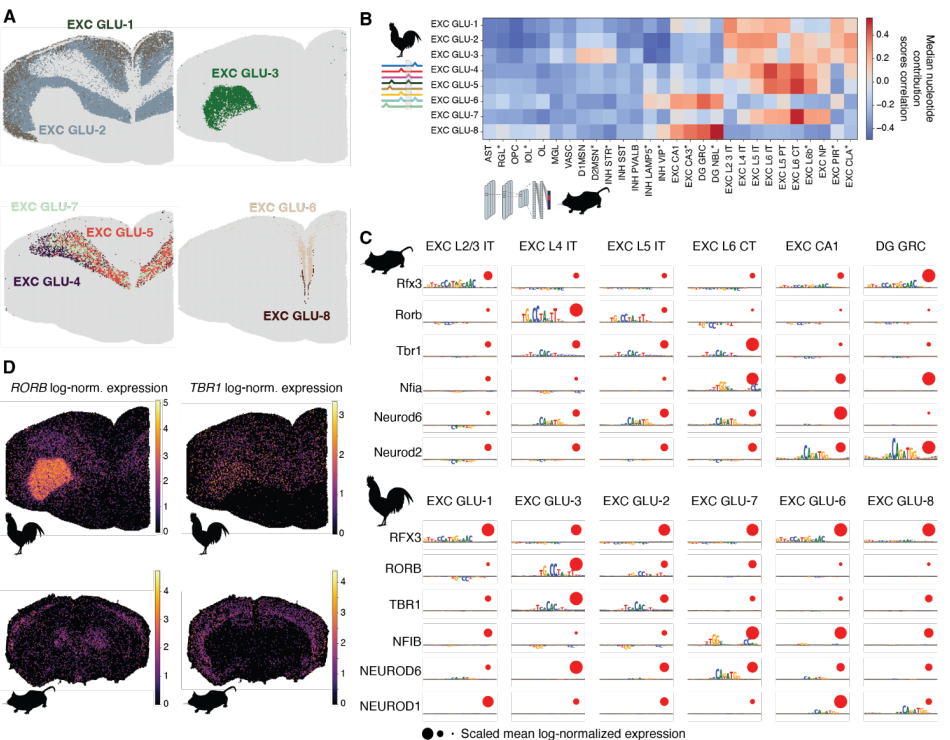
与保守细胞类型相反,兴奋性神经元展现出复杂的“多对多”同源关系。鸡端脑中8个兴奋性神经元簇分别与哺乳动物不同皮层层次的神经元存在部分相似性,这种调控模式的多样性打破了传统的一一对应进化模型(图3)。
研究建立了四重验证体系:转录组比较、基于序列的模型的预测、衍生的核苷酸贡献分数的相关性和TFBS基序的相似性分析。这一框架显示,非神经元细胞相似性接近1(满分),而兴奋性神经元得分分散,印证了其进化复杂性(图4)。
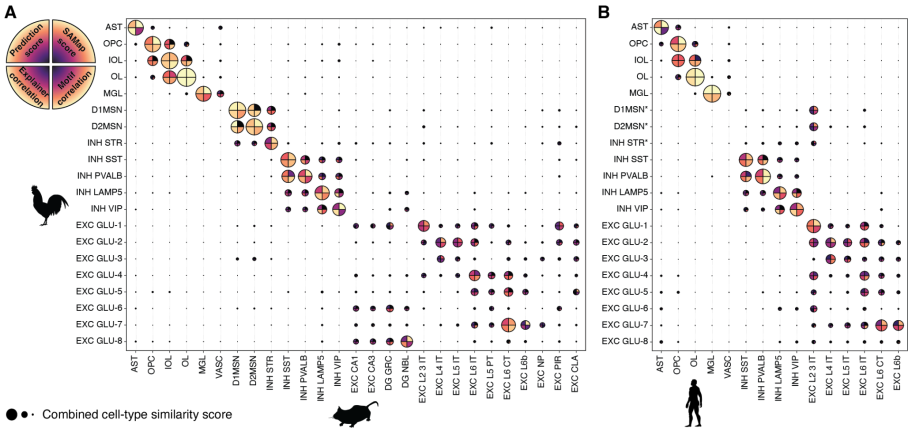
图4 鸡-小鼠和鸡-人类脑细胞类型间调控编码匹配方法概述
这项研究之所以被称为 “里程碑式”,不仅因为它解答了长期存在的进化争议,更带来了两大突破。
一方面,时空组学技术与深度学习的结合,让跨物种比较进入 “精准解码” 时代。以前研究只能对比基因表达,现在能直接解析 “基因开关” 的编码规律,相当于从 “看表面” 深入到 “看核心”。
另一方面,研究为疾病研究提供了新线索。既然非神经元细胞和 GABA 能神经元的增强子编码高度保守,那么这些基因调控机制的异常,可能是不同物种共有的疾病根源;而兴奋性神经元的进化多样性,或许能解释不同物种认知功能的差异。
简单来说,这项研究让我们明白:鸟类和哺乳动物的大脑,在进化中既保留了核心的 “通用机制”,又发展出了独特的 “专属功能”。当 “基因序列” 和 “空间位置” 被同时解析,生命科学正在迈入一个更精准、更深入的探索阶段,未来还会有更多进化奥秘等着我们揭开。