华大生命科学研究院联合中山大学肿瘤防治中心、华南恶性肿瘤防治全国重点实验室等多家科研单位,利用华大自主研发的时空组学技术Stereo-seq和单细胞转录组测序技术DNBelab C4绘制了错配修复系统完善型(proficient-mismatch repair,pMMR)结直肠腺癌的空间转录组图谱,揭示了恶性粘膜中的不连续炎症模式,表征了免疫“热”区的分子特征,为后续改善pMMR肿瘤在免疫检查点阻断治疗中的不敏感性提供了理论基础。
该研究2022年3月15日在Fundamental Research上发表,以下是该文章的详细解读。

文章题目:Spatial transcriptome unveils a discontinuous inflammatory pattern in proficient mismatch repair colorectal adenocarcinoma
发表时间:2022-03-15
发表期刊:Fundamental Research
主要研究团队:华大生命科学研究院、中山大学肿瘤防治中心、华南恶性肿瘤防治全国重点实验室等
DOI:10.1016/j.fmre.2022.01.036
不可预测的基因突变和癌症细胞及其周围环境的相互作用加剧了癌症的复杂性。已有研究表明,免疫系统成分渗入肿瘤微环境(tumor microenvironment,TME)可能导致“热”(免疫评分高)或“冷”(免疫评分低)的抗肿瘤反应且与临床治疗紧密相关。然而,由于肿瘤突变负载低和免疫细胞浸润不足等导致大多数癌症患者对免疫疗法的反应不足。目前已知的是,相比于错配修复系统完善型(proficient-mismatch repair,pMMR)结直肠癌(colorectal cancer,CRC),错配修复系统缺陷型(deficient-mismatch repair,dMMR)CRC对免疫检查点阻断(immune checkpoint blockade,ICB)治疗响应效果更好。
然而,只有15%的CRC患者存在dMMR,而超过80%的CRC患者对免疫疗法不敏感。海量基于scRNA-seq的研究促进了对免疫细胞的认识,但是scRNA-seq丢失了细胞空间位置信息而难以表征出肿瘤空间异质性。因此,需要对结直肠腺癌开展系统的空间转录组分析,表征出dMMR和pMMR的细胞组成差异,以确定病理注释的癌症区域中所涉及的免疫反应分子模式,促进对结直肠癌免疫生态系统及分子机制的理解。
6例结直肠腺癌(colon adenocarcinoma,COAD)患者的手术切除的结直肠组织。采用华大自主研发的时空组学技术Stereo-seq,对4例pMMR肿瘤样本及2例配对的远端正常组织进行分析。同时,采用华大的scRNA-seq技术(DNBelab C4)对2例结直肠癌样本进行单细胞转录组测序。
- 研究成果 -
1. COAD配对样本的空间转录组图谱揭示空间免疫异质性
研究人员首先描绘了COAD具有空间变化的转录景观。借助华大可以实现纳米级分辨率时空组学技术Stereo-seq,对4个治疗性II至III期COAD样本和2个配对的远端正常样本进行空间转录组测序,并利用苏木精和伊红(H&E)染色进行病理学注释(图1a、b)。以bin100(50 μm × 50 μm)的分辨率表征出COAD癌症特征基因包括MKI67、CDH1、EPCAM、KRT8/19/20等的空间分布(图1b),利用Bayesspace进行空间聚类(图1b)并结合inferCNV分析拷贝数变异(copy number variance,CNV)的差异,发现肿瘤细胞分布与CNV相关(图1b、d、e),进一步探索了COAD的空间遗传变异。
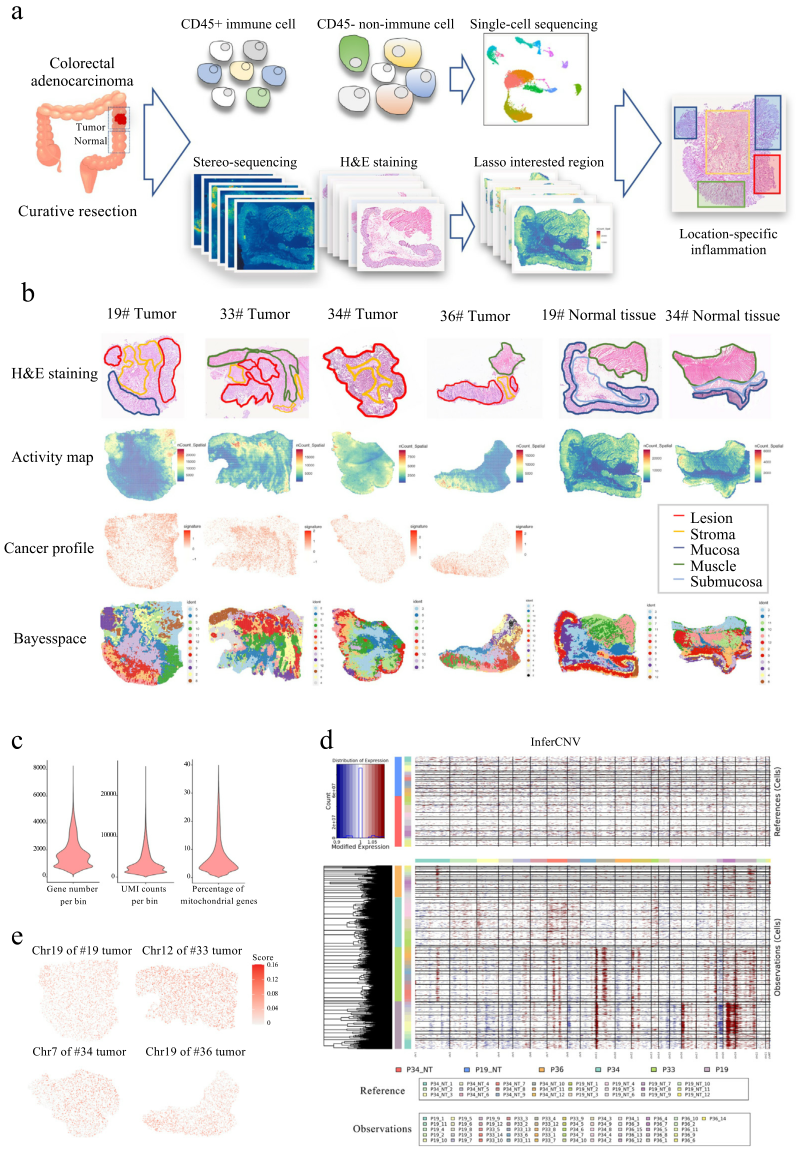
图1 COAD空间转录组图谱
为了解析COAD的免疫动力学,研究人员整合了癌症和正常标本的粘膜亚群,通过差异分析和基因功能富集分析表征出恶性粘膜的593个高表达基因及其功能。研究人员发现19号pMMR患者的恶性粘膜细胞亚群均存在中性粒细胞相关反应的富集(图2 a、b)。更重要的是,研究人员发现癌症细胞亚群(Cluster10)中干扰素-γ相关反应、抗原加工和呈递活性等上调,提示针对癌细胞的免疫“热”区(图2a-e),揭示了即便普遍被认为是“冷”肿瘤的pMMR结直肠癌中,也有少部分样本会存在局部的免疫“热”区。
研究人员进一步选择了10个top差异高表达基因作为免疫“热”区标记基因并用于绘制266名COAD患者(来自TCGA数据库,2012)的生存曲线,发现具有较高免疫“热”区标记基因的患者生存率都有所提高(图2g)。通过比较“热”和“冷”细胞亚群的拷贝数增益或损失分数,研究人员确定了35个免疫“热”区表现出增益的基因(图2h),并进一步表征出OFLM4的过表达可能是炎症性区域形成的潜在原因(图2g)。
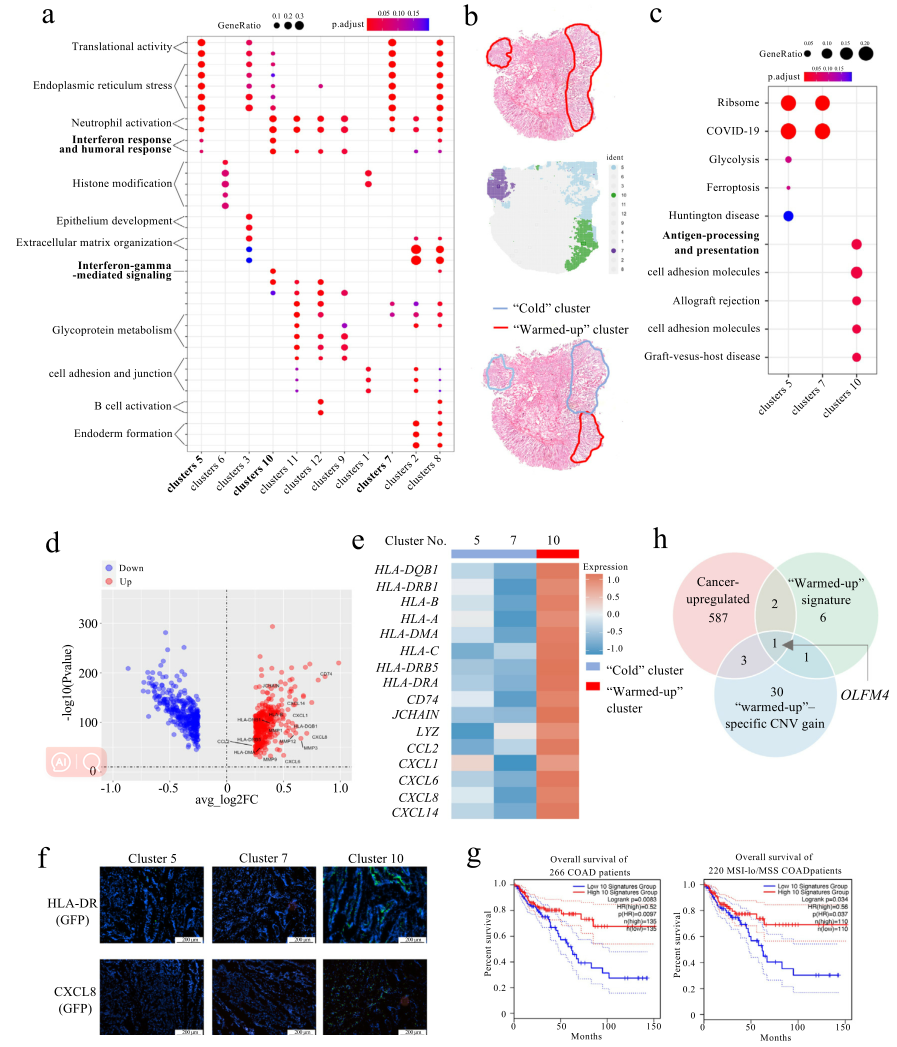
3. 免疫细胞浸润增加和免疫“热”区中的组织重塑增强相关
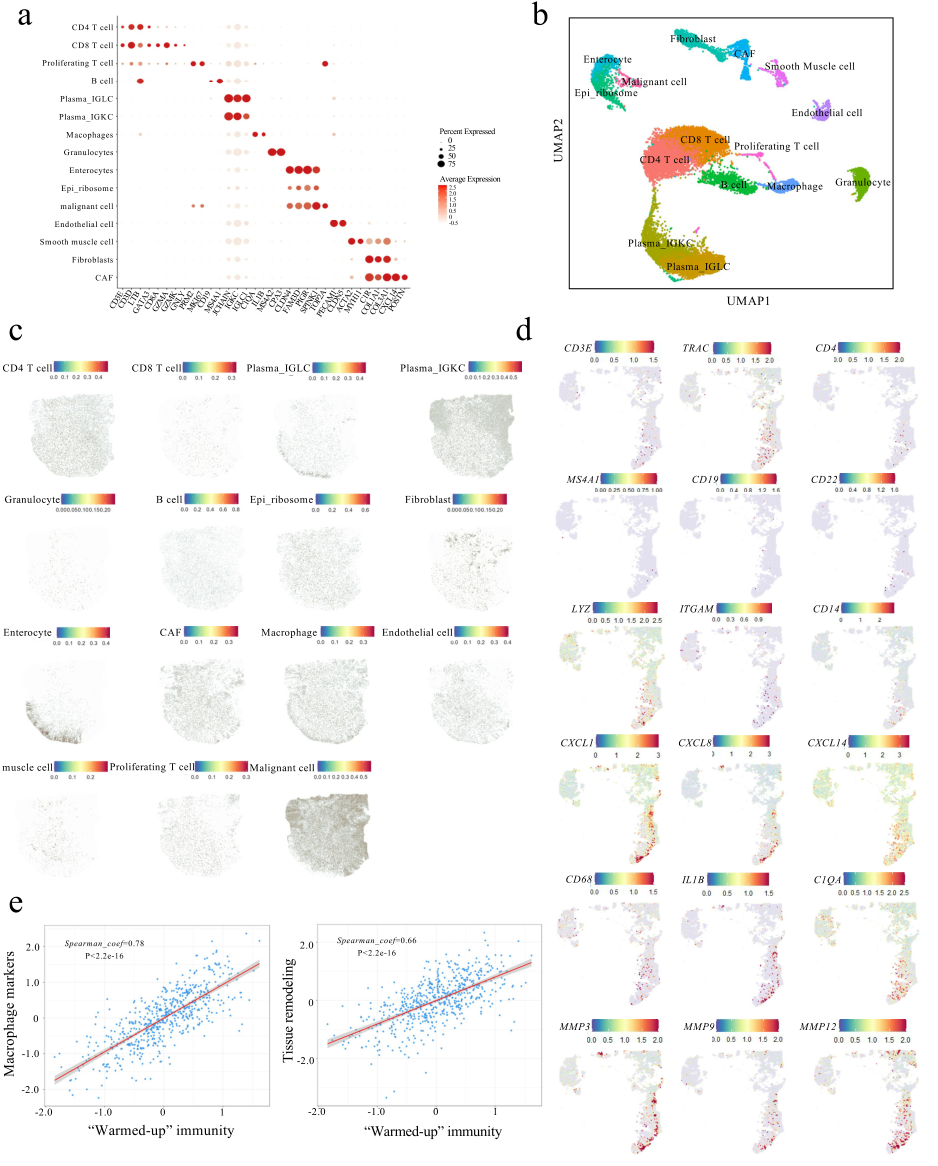
为了进一步表征“热”区的免疫成分,研究人员对2例COAD肿瘤样本进行scRNA-seq(图1a),经过严格的质量控制和过滤后得到了17,503个高质量细胞。无监督聚类确定了15种细胞类型并利用Spotlight映射到19号患者的空间转录组数据上(图3a-c),CD4 T细胞、巨噬细胞、B细胞和成纤维细胞在免疫“热”区浸润(图3c、d),结合594名CRC患者的“热”免疫基因与巨噬细胞和组织重塑标志物之间的相关性分析(图3e),进一步揭示了免疫增强与组织重塑过程之间存在局部联系。
该研究利用Stereo-seq结合scRNA-seq,绘制了pMMR结直肠腺癌的空间转录组图谱,揭示了肿瘤免疫微环境的空间异质性。通过评估同一样本的癌症注释区域内的局部特异性遗传变异和显著免疫渗入的异质性,揭示了病理学注释的CRC粘膜中不连续的炎症模式,并进一步表征了免疫“热”区的分子特征。该研究对于了解肿瘤微环境中的免疫反应模式以及指导临床实践中的免疫治疗策略具有重要意义。
中山大学肿瘤防治中心副主任张荣欣、马文娟博士、华大生命科学研究院专项科学家冯驭为共同第一作者;华大生命科学研究院院长徐讯、华大生命科学研究院时空组学领域首席科学家陈奥、华大生命科学研究院单细胞组学领域首席科学家刘龙奇、中山大学肿瘤防治中心陈功教授为共同通讯作者。
内容 | Jingle
审校 | 冯驭、沙金、黎晓玲




